CDE公开征求《化学仿制药晶型研究技术指导原则(征求意见稿)》
日期:
2021-09-27
浏览次数:
166
2021年9月26日,为进一步明确化学仿制药晶型研究相关技术要求,CDE起草了《化学仿制药晶型研究技术指导原则》(征求意见稿),现在CDE网站予以公示,以广泛听取各界意见和建议。
CDE原文链接:https://www.cde.org.cn/main/news/viewInfoCommon/e90a7d798f1a2a86e6a5798247c9454e
1. 概述
2. 总体考虑
2.1 仿制药晶型选择
2.3 仿制药晶型研究思路
3. 仿制药研发中晶型问题的关注点
3.1 晶型与生物利用度/生物等效性
3.2 晶型与制剂工艺
3.3 晶型稳定性
3.4 晶型药物仿制药中晶型控制方法的制订
4. 药物晶型的表征和控制
4.1 晶型表征
4.2 晶型控制
5. 决策树
6. 名词解释
7. 参考文献
多晶型现象是指同一化学结构分子因存在多种不同的排列形式和分子构象而形成不同晶型的现象。原料药的不同晶型可具有不同的物理和化学性质,可能对原料药及制剂的稳定性、制剂的生产工艺、溶出度及生物利用度等产生影响,进而可能影响药物的安全性、有效性和质量可控性,所以研究原料药的多晶型现象以及晶型可能对药物全生命周期各环节产生的影响,是保证药物质量的核心内容和关键环节,对化学仿制药的研发具有重大意义。本指导原则结合我国仿制药晶型研究的现状并参考国外监管机构相关指导原则起草,旨在明确仿制药晶型研究过程中的关注点,涉及的晶型包括无水物、水合物、溶剂合物和无定型等。
本指导原则仅代表药品监管部门目前对于该问题的观点和认知。随着科学和技术的进展,本指导原则中的相关内容将不断完善与更新。申请人应基于风险评估的理念,在全面理解参比制剂目标质量概况的基础上,选择适宜的晶型进行处方工艺开发。化学仿制药晶型研究主要包括两方面内容:一是原料药多晶型的种类,重点晶型的制备、表征及理化性质研究;二是原料药多晶型对制剂工艺和疗效等可能产生的影响,根据研究结果选择适宜晶型。
1. 仿制药晶型选择
申请人应对原料药的多晶型现象有足够的认识。可以通过科学文献、专利以及其他相关的参考资料,或通过晶型筛选试验获得相关数据。晶型筛选应关注在原料药和制剂制备和贮存过程中可能会生成或转化的晶型。对于仿制药,通常情况下应选择与参比制剂一致的晶型,若有足够的试验数据证实其他晶型制备的仿制药与参比制剂生物等效且具有合适的稳定性,也可选择与参比制剂不同的晶型。无论选择何种晶型,均应对所选择晶型进行充分的理化性质和稳定性研究。
2. 仿制药晶型研究思路
对于仿制固体制剂、半固体制剂和混悬剂,应主要考虑晶型对原料药及制剂工艺和稳定性的影响,以及对制剂溶出和生物利用度/生物等效性的影响,在充分研究晶型对其影响的基础上,确定是否有必要对药物的晶型进行控制。对于液体制剂(如口服液、注射液等),建议关注原料药的不同晶型对制剂工艺过程可能产生的影响。
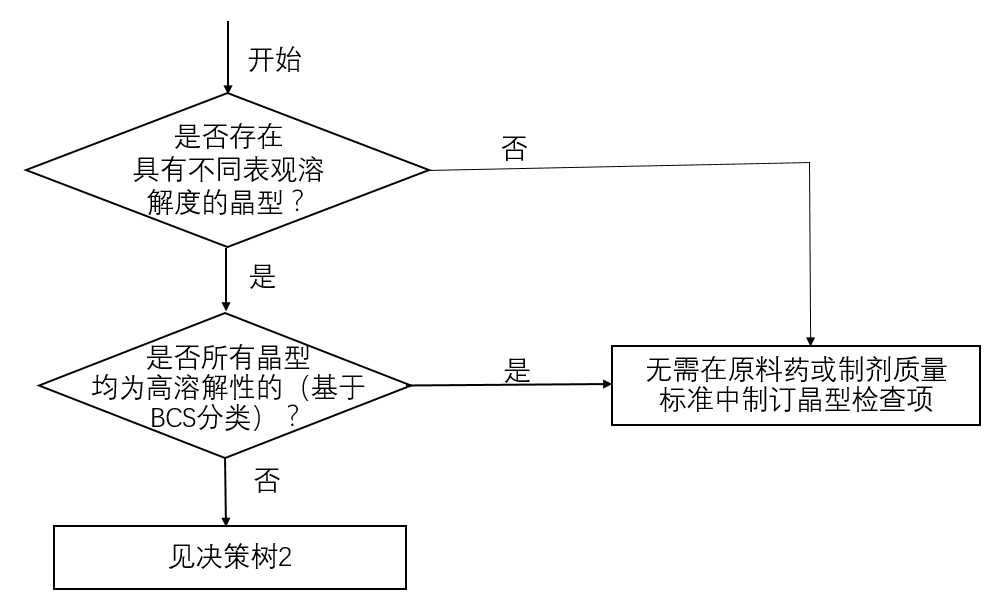
由于原料药不同晶型的内部分子排列或分子构象不同,所以可能存在溶解度和溶解速率的差异。当原料药不同晶型的表观溶解度存在差异时,建议申请人关注这种差异是否会影响制剂生物利用度/生物等效性。原料药不同晶型的表观溶解度差异是否会影响制剂生物利用度/生物等效性,取决于影响药物吸收速度和程度的各种生理学因素,包括胃肠道蠕动、药物的溶出、药物的渗透性等。此时,生物药剂学分类(BCS)可科学地评价多晶型现象对制剂生物利用度/生物等效性影响程度,使用BCS分类进行评估时,应自证拟开发品种的BCS分类。对于体内吸收仅受溶出速度限制的高渗透性药物,若不同晶型之间表观溶解度差异较大,就很可能影响生物利用度/生物等效性。而对于吸收仅受肠道渗透性限制的低渗透性、高溶解性药物,各晶型之间的表观溶解度的差异对生物利用 度/生物等效性的影响相对较小。对于高溶解性药物,当各晶型的表观溶解度均足够大,药物的溶出速度快于胃排空速度时,各晶型之间的表观溶解度的差异对生物利用度/生物等效性的影响不明显。在证明仿制药与参比制剂体内生物等效后,溶出度检查可用于评价仿制药的批间一致性。当晶型转变可能影响制剂的生物利用度或生物等效性时,可通过溶出度检查作为监控方法,但应提供研究资料论证所用溶出方法能反映上述变化。原料药的不同晶型可呈现不同的物理和机械性质,包括吸湿性、颗粒形状、密度、流动性和可压性等,进而可影响原料药的纯化和/或制剂的生产。鉴于原料药多晶型可影响制剂工艺的稳健性,故建议申请人密切关注原料药的多晶型。多晶型对制剂生产过程的影响还与制剂处方和工艺有关。例如,对于粉末直压的工艺,尤其是当原料药在处方中所占的比例较大时,原料药的固态特征是药物制剂生产的关键影响因素;而对于湿法制粒工艺,原料药的固态特征通常被制粒过程所改变或掩盖,其固态特征对生产的影响可能就比较小。关于原料药多晶型对制剂工艺的影响,需要考虑的关键问题是确保能够持续稳定地生产出符合过程控制和放行标准的制剂。原料药经干燥、粉碎、制粒和压片等制剂工艺步骤,在温度和湿度等环境因素的作用下,均可能出现转晶现象,其晶型转变的程度往往取决于不同晶型的相对稳定性、相转变能垒,以及外加应力。应对工艺过程中晶型转变情况进行充分的研究。在药物开发过程中,为了降低转晶的可能性,以及得到更好的化学稳定性,通常选择热力学最稳定的晶型。在某些情况下(如基于提高难溶性药物生物利用度等考虑)如果选择亚稳态晶型或无定型作为开发晶型,应证明所选择晶型在生产和贮存过程中具有足够的物理和化学稳定性,特别关注药物晶型的稳定性,并采取适当的措施(如适当的处方、生产工艺、包装等)避免在贮存期间亚稳态晶型向稳定型晶型转变。决策树1-3为仿制药申请人提供了策略过程,该过程用以评估多晶型对晶型药物仿制药的重要性,以及制订晶型控制方法的各种方式。虽然决策树采纳的理论框架主要是基于多晶型影响制剂生物等效性/生物利用度的潜在因素而建构,但建议申请人仍要考虑多晶型对制剂工艺稳健性产生的影响,以及对制剂稳定性产生的影响。决策树1为原料药和/或制剂标准中制订晶型检查项的建议。如果原料药所有晶型表观溶解度没有差异或者均为高溶解性,则原料药的不同晶型对生物利用度/生物等效性产生显著影响的可能性较小,因此通常情况下无需在原料药和/或制剂中制订晶型检查项。
按照BCS分类系统对药物的溶解性进行区分,当原料药的至少一种晶型属于低溶解性时,可参考决策树2制订该原料药晶型检查项。若中国药典中收载了晶型检查项,且该项适用于目标晶型的控制,可在原料药质量标准中采用与药典相同的晶型检查项。若中国药典没有收载晶型检查项,或该项不适用于目标晶型的控制,申请人应参考相关文献(如,其他国家药典等)并在充分研究的基础上制订新的晶型检查项。
可参考决策树3选择制剂中晶型的控制策略。通常,如选择的晶型是热力学最稳定的晶型,或者选择与参比制剂使用相同的晶型,通常情况下无需在制剂质量标准中制订晶型检查项,但如果选择的是亚稳态晶型,由于亚稳态晶型可能在制剂工艺和贮存过程中发生晶型转变,需要进行相关研究并依据研究情况决定是否在制剂质量标准中制订晶型检查项。对于难溶性药物,如果晶型变化对生物利用度/生物等效性的影响可通过制剂的性能检测(如,溶出度)进行控制时,可通过溶出度等性能检测项替代晶型控制。如果需要对晶型 进行控制,且难以建立制剂其他质控指标与晶型之间关系时,应在制剂质量标准中制订反映晶型变化的其他检测项(如,固态表征等)。常用的晶型表征方法包括:单晶X射线衍射法(SXRD)、粉末X射线衍射法(PXRD)、红外光谱法(IR)、拉曼光谱法(Raman)、差示扫描量热法(DSC)、热重法(TG)、毛细管熔点法(MP)、光学显微法(LM)、偏光显微法(PM)、固体核磁共振波谱法(ssNMR)等。其中,单晶X射线衍射法和粉末X射线衍射法是目前公认的最可靠方法。热分析方法(如,差示扫描量热法、热台显微镜法等)和光谱法等(如,红外光谱法、拉曼光谱、固体核磁共振波谱法等)均可进一步支持不同晶型的确证。
鉴于上述所提及的表征方法多数仅能反映不同晶型某一方面的物理性质,因此,申请人应结合申报品种和拟采用晶型的特点等选择适宜的方法对晶型进行表征。
可参照《中国药典》相关通则对晶型进行定性和/或定量分析。其他国际公认用于物相分析的方法也可对晶型进行定性或定量分析,确保原料药或制剂中有效晶型的含量。常用的定量方法包括:粉末X射线衍射法(PXRD)、红外光谱法(IR)、差示扫描量热法(DSC)、拉曼光谱法(Raman)、固体核磁共振波谱法(ssNMR)等。决策树1 制订晶型检查项的必要性

决策树3 制剂晶型检查项的制订
多晶型现象(同质异晶现象):描述固体化学药物物质状态,可由一组参量(晶胞参数、分子对称性、分析排列规律、分子作用力、分子构象、结晶水或结晶溶剂等)组成,当这些参量中的一种或几种发生变化,而使其存在有两种或两种以上不同的固体物质状态。晶态:指分子在晶格中具有周期性、对称性的排列规律。
晶型药物:指药效成分以特定晶型状态存在的固体药物,尤其是固体化学药物。
无定型:指分子的排列没有周期性规律。
无水物:指不含结晶水或结晶溶剂的晶态物质。
溶剂合物:指含有化学计量或非化学计量溶剂的晶型物质。
水合物:如果溶剂合物的溶剂为水,该溶剂合物通常被称为水合物。
表观溶解度:物质在表观平衡(过饱和)状态下的浓度。表观溶解度不同于真正的热力学溶解度,真正的热力学溶解度是在无限平衡时达到的。
转晶现象:化合物晶型物质状态因环境条件变化(如:温度、湿度、光照、压力等)而从某种晶型物质状态转变为另外一种晶型物质状态。
热力学最稳定晶型:具有多晶型的化合物,在给定温度和压力下,吉布斯自由能最低的形式。
1. 国家药品监督管理局《药品注册管理办法》(2020年 1月22日国家市场监督管理总局令第27号)2. 国家食品药品监督管理总局《化学药品注册分类改革 工作方案》(2016年3月)3. 国家食品药品监督管理总局药品审评中心《化学药物 原料药制备和结构确证研究的技术指导原则》(2005年3月)4. 国家食品药品监督管理总局药品审评中心《化学药物 制剂研究基本技术指导原则》(2005年3月)5. 国家食品药品监督管理总局药品审评中心《已有国家 标准化学药品研究技术指导原则》2007年6. 国家食品药品监督管理总局《化学药物(原料药和制 剂)稳定性研究技术指导原则》(2015年第3号)7. 国家食品药品监督管理总局:总局关于发布化学药品新注册分类申报资料要求(试行)的通告(2016 年第80 号)8. 国家食品药品监督管理总局:总局关于发布化学药品 仿制药口服固体制剂质量和疗效一致性评价申报资料要求(试行)的通告(2016年第120号)9.《中国药典》2020年版四部通则,9015药品晶型研究及晶型质量控制指导原则10. ICH Q3A: Impurities in New Drug Substances. 200611. ICH Q6A: Specifications Test Procedures and AcceptanceCriteria for New Drug Substances and New Drug Products Chemical Substances.199912. Food and Drug Administration. Guidance for Industry. ANDAs:Pharmaceutical Solid Polymorphism. July 200713. USP General Chapters<1236>:SOLUBILITYMEASUREMENTS14. USP General Notices and Requirements15. EUROPEAN PHRMACOPOEIA 10.0: 5.9. POLYMORPHISM16. JP17 XVII General Tests2.58:X-Ray Powder Diffraction Method17. WHO Technical Report Series 970,WHO Expert Committee on Specifications for Pharmaceutical Preparations,Forty-sixth report.18. WHO POLYMORPHISM Draft chapter for The International Pharmacopoeia. December 2018.