来源:中国医药报
2017年07月24日 发布
2015年,一个对中国药品监管来说不同寻常的年份。
当年7月,国家食品药品监督管理总局发布《关于开展药物临床试验数据自查核查工作的公告》(2015年第117号)。10月末,第一批临床试验数据核查员奔赴药物临床试验机构开展数据核查。从此,我国药品监管与国际接轨,药物创新研发步入崭新时代,全世界的目光被中国的这一改革所吸引。中国13亿人民用药安全的殷殷期盼在一代食药监人大无畏的改革中变为现实……
7月21日,国家食品药品监督管理总局审核查验中心(以下简称核查中心)发布《药物临床试验数据核查阶段性报告》(以下简称报告),总结回顾开展药物临床试验数据核查两周年的历程。
报告显示,国家食品药品监督管理总局开展药物临床试验数据核查两年来,共派出185个检查组,对313个药品注册申请进行现场核查,整肃了我国药品研发领域不规范行为,营造出科学、公平的创新研发环境,圆满完成了总局向国家和人民承诺的阶段性任务。
历史呼唤 敢为人先
时间回到2015年。
2015年5月29日,习近平总书记在中共中央政治局第二十三次集体学习时对食品药品安全工作做出重要指示,要求用“最严谨的标准、最严格的监管、最严厉的处罚、最严肃的问责,确保广大人民群众饮食用药安全”……而彼时,摆在食药监系统面前最亟待解决的问题就是保障每一个审批上市的药品安全有效,护佑人民的健康。2015年8月9日,国务院下发《关于改革药品医疗器械审评审批制度的意见》(国发〔2015〕44号),要求“严肃查处注册申请弄虚作假行为。加强临床试验全过程监管,确保临床试验数据真实可靠”。
众所周知,我国是仿制药生产大国,医药产业经过30年的高速发展,医药工业总产值已经突破2.8万亿元,成为全球第二大医药市场。然而,在满足了13亿人口的基本临床用药可及性后,我国药品生产结构性问题也日益突出,即仿制药同质化严重、低水平重复、创新研发基础薄弱,亟待从制药大国向制药强国转变,而作为创新研发重要的一环——临床试验数据检查过去从未开展过。
对于开展临床数据核查的意义,核查中心主任丁建华说:“过去,我国医药产业水平较低,监管注重认证与检验,目标是强基础。由于药品质量责任主体不清晰,一些企业在认证完成后不能坚持标准,被查出很多问题。近两年,我国药品监管理念发生重大变化,逐步与国际接轨,持续开展药品全生命周期检查,将检查作为监管的重要手段,收到较好效果。临床试验数据的真实、科学、可靠是药物审评审批的重要基础,也是开展技术审评的基本保证,开展临床试验数据核查是从药品研发源头遏制企业急功近利、弄虚作假行为,推动药品审评审批制度改革。
按照总局向国务院的承诺,到2017年6月30日,我国药品临床试验数据核查要完成289个品种。2015年10月末,我国第一批临床试验数据核查员悄然出发,奔赴临床基地开展核查。这看似小小的一步,却是我国药品监管发展进程中的一大步。总局局长毕井泉在“药物临床试验数据核查工作座谈会”上指出,在临床数据核查工作中,要严惩故意造假,要一把尺子量到底,决不能前紧后松,决不能让“老实人”吃亏。要通过对极少数临床数据造假责任人的处罚,警示和教育大多数,重建药品研发生态,促进制药行业健康发展,确保公众用药有效安全。
战鼓已经擂响。历史的使命,改革的呼唤,让食药监人义无反顾地踏上了充满荆棘之路。
迎难而上 砥砺前行
“当接到开展临床数据核查任务时,我们只有15名检查员。”核查中心研究核查处相关负责人回忆,在开展核查最初的日子里,高负荷的工作令每一名参与者都像是上紧了发条不停地旋转。
人手不够,核查中心就向全国各相关机构发出“英雄帖”,经过严格招聘,在最短的时间内建立了检查员库,一大批具有专业背景和研究经验的人员充实到检查一线岗位。这些检查员均具有临床试验相关的资质和经验,并经过系统性培训和考核,专业背景涵盖临床医学、生物统计、生物分析、公共卫生等。目前共有500余名检查员参加了现场核查工作,检查员来自于核查中心、中检院、药审中心、药典委、各省局、各大专院校及医疗机构。此外,核查中心还建立了外部检查员选择和使用管理办法,对核查工作的保密性、独立性和利益冲突等进行管理。为加强检查员的廉政意识,每次检查前核查中心都对检查组进行集中培训,统一标准和认识。一名放弃高薪的外企白领在参加招聘时坦言,“检查员工作神圣,我想用自己的专业知识保护每一位亲人的用药安全。”
临床试验数据核查工作社会关注度极高,稍有不慎就有可能被置于舆论的风口浪尖,因此,建立科学、严谨的检查程序极为关键。为此,核查中心在检查员培训、现场检查准备、现场检查实施、检查结果报告、检查资料存档等环节都制定了工作程序,并对现场核查过程进行质量监控。
制定现场核查计划。药审中心根据审评进度和评价需要,向核查中心提供需要核查的品种情况。核查中心按审评顺序、自查报告填报情况以及举报信息等情况拟定现场核查计划。
核查计划公示。从2016年3月至2017年6月底,共发布药物临床试验数据现场核查计划公示12期351个品种,公示期为10个工作日,在公示后10个工作日内未提出撤回申请的视为接受现场核查。
开展现场核查。检查组根据《药物临床试验数据现场核查要点》(2015年第228号公告)进行核查,确保各组间尺度一致。根据注册申请类型,对Ⅱ/Ⅲ期临床试验平均检查试验场点4个,平均检查时间7天;生物等效性试验检查临床部分与生物样本分析部分,平均检查天数4天。
集中会审。核查中心建立了由临床医学、药学、生物分析、医学检验、医学统计、医学伦理等各专业专家组成的委员会,采用盲审的方式对核查结果进行集中会审,确保会审结果客观公正。
反馈沟通核查情况。集中会审后,核查中心向药品注册申请人和主要研究者反馈和沟通核查情况。如有异议可进一步提交资料,申请二次会审。截至2017年6月底,共组织召开沟通会14次,参会人员超过920人次,答疑近500条。
核查意见转药审中心。综合核查意见与沟通情况,核查中心形成明确的核查意见,随相关材料转药审中心进行综合审评。从现场核查开始到核查意见转药审中心的平均时间为24个工作日。
“数据核查是国家食药监部门通过行政手段,以最严谨的标准,最严格的监管,最严厉的处罚,最严肃的问责来保证药品质量和国民的用药安全。数据核查重创了国内部分药企急功近利的违规行为,同时食药监部门建立起了更加完善明确的审查要求和质量规范,对创新药的研发进一步明确了审评审批的具体要求,这些严谨、科学、透明的审批尺度,有力地保障了创新药研发的生态环境,也提高了企业对创新药研发的积极性。”泰德制药研发相关负责人说。
石药集团研发助理总裁王荣瑞说,临床数据核查在全行业营造了公平、规范、科学的创新研发环境,企业的创新劲头越来越足。
有条件要上,没有条件创造条件也要上。在改革者面前,任何困难都将被强大的信念和无畏的行动所征服。中国药物创新研发虽起步艰难,但前景美好!
助力创新 走向国际
总局开展临床试验数据核查两年来,取得的成绩有目共睹:彻底扭转了我国药品研发领域的浮夸风气,尊重科学、崇尚真实的氛围正在形成,向党和人民交上了一份满意的阶段性答卷。截止到2017年6月底,核查中心共派出检查组185个,组织检查员1635人次,对313个已提交自查资料的药品注册申请进行了临床试验数据现场核查,其中,新药注册申请94个,仿制药注册申请37个,进口药注册申请182个。核查药物临床试验机构763家次,生物样本分析单位121家次,分布于全国28个省、自治区和直辖市(见下表)。
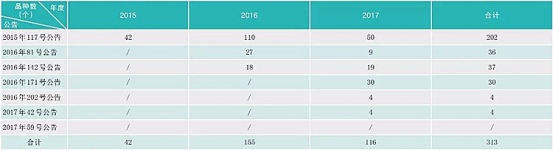
药物临床试验数据核查工作进度
“开展数据核查对于医药企业的创新质量提升和国际接轨都有正面作用。”中国化学制药工业协会执行会长潘广成介绍,近年来创新企业越来越多,一些企业到国外建厂或者做临床试验,他们越来越感到临床数据真实性对创新研发和国际化的重要性。保持临床数据的真实性和完整性将是企业做大做强、走向国际化的必由之路,创新企业和出口型企业在这方面体会更深。“一家企业曾反映,FDA到企业检查的时候,不光要核查当年的数据,还要把前几年的数据一并调出来检查,看与企业的申报是否一致。”潘广成说。
他介绍,协会近些年也一直从软件和硬件上推动企业重视数据的真实性。“我们一方面推动企业从意识上重视数据真实性和完整性,一方面从硬件上推动设备自动化和信息化的结合,后者在数据记录上减少了人为干预的概率,有利于减少数据造假的发生。”
开展临床试验数据核查两年来,我国药物创新研发进入崭新阶段,临床试验数据真实、科学蔚然成风,从“7·22”医药企业面对核查无信心地大面积撤回仿制药注册申请,到目前企业创新立项谨慎、临床申报谨慎、仿制药注册申请撤回率大大降低,临床数据核查像一股强劲之风,将盘踞于新药研发领域的沉疴顽疾荡涤一新。
过去两年,罗氏申报了3个临床试验品种,这三个品种先后成功通过总局临床数据核查。“罗氏公司欣喜地看到两年来CFDA取得的成绩,检查工作公开透明,核查人员业务能力不断提高,检查工作规范性和统一性不断提升。我们认为,开展临床数据核查是对中国医药企业的重大利好,既有利于净化医药研发的‘生态环境’,促进研发水平提升,又促进了国内新药和仿制药走出国门。随着与国际接轨的核查标准不断完善提高,对国内研究机构和研究者也提出了更高的要求,只有经过科学和严谨的研究验证过的药物,才能真正惠及中国患者。”罗氏公司亚太区注册负责人吕玉真说。
记者了解到,开展临床试验数据核查以来,医药企业、临床机构更为重视试验细节,加强了临床试验的监督力度,数据真实性、规范性得到大幅提升。与此同时,总局推出一系列政策破解临床试验资源不足等难题。
一家大型中药企业研发负责人表示,我们的一个产品正在美国做临床试验,一个病例要花费5万美元,我们不怕花钱,怕的就是花了钱临床试验不客观、有水分。总局开展临床试验数据核查后,临床机构的重视程度大幅提高,能力水平得到了长足进步。我们支持总局的改革,我们希望临床试验更规范一些,门槛更高一些,只有这样,中国制造才能真正走向国际市场。
持续提升 改革到底
任何改革都非一蹴而就,关键是总结成绩,改革到底。
报告显示,经过对313个药品注册申请的现场核查报告进行分析,共发现5111条缺陷项。其中临床部分4583条,平均每个临床试验机构发现问题6条;生物分析部分528条,平均每个生物样本分析单位发现问题4.4条。依据《药物临床试验数据现场核查要点》对缺陷进行分类,发现缺陷条款数量最多的方面依次为:临床试验过程记录及临床检查、化验等数据溯源方面(占28.1%),方案违背方面(占12.0%),试验用药品管理过程与记录方面(占11.6%)和安全性记录、报告方面(占10.1%),共发现缺陷3161项,占61.8%(见图1)。
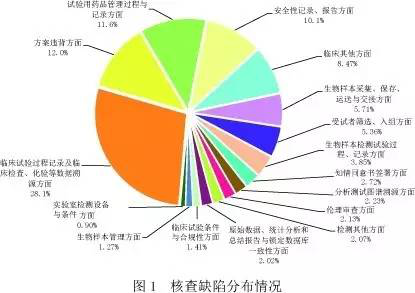
对临床部分现场核查发现的4583项缺陷汇总分析,显现出频次最高的缺陷条款(见图2)。
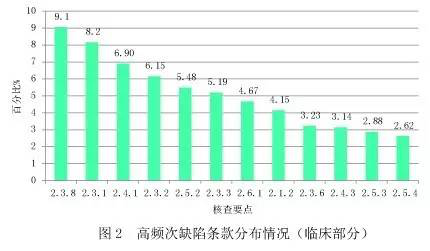
对分析测试部分现场核查发现的528项缺陷汇总分析,显现出频次最高的缺陷条款(见图3)。

王荣瑞认为,我国药品生产质量规范也走过了发展、成熟到完善的过程。因此,企业在临床数据核查中遇到的问题都将在持续改革中逐渐解决。
今年5月,总局发布《关于鼓励药品医疗器械创新加快新药医疗器械上市审评审批的相关政策》等四个征求意见稿,将药品审评审批改革再次推向高潮。国家卫计委科技司重大专项处处长顾金辉感叹于国家总局在药品审评审批改革中的巨大变化,称“改革的速度和力度前所未有”。
江苏恒瑞医药股份有限公司研发总监朱林表示,总局重视研发监管,特别是开展临床试验数据核查以来,扭转了研发领域“劣币驱良币”的状态,投机取巧的企业无法过关,让企业更放心地开展创新研发。经过临床试验数据核查,企业更加深刻理解了“研发最重要”几个字的含义,“我们真心为改革叫好!”
“潮平两岸阔,风正一帆悬”。开展临床试验数据核查两年来,食药监人用实际行动践行习近平总书记“四个最严”的要求,为保障人民群众用药安全,在改革的道路上披荆斩棘,勇往直前。
文/中国医药报记者 方剑春